Reaksi substitusi adalah reaksi penggantian atom atau gugus atom oleh
atom atau gugus atom lain. Jadi dalam reaksi substitusi suatu atom atau gugus
atom yang terdapat dalam rantai utama akan meninggalkan rantai utama tersebut
dan tempatnya yang kosong akan diganti oleh atom atau gugus atom yang lain. Reaksi substitusi dapat terjadi pada atom
karbon jenuh atau tak jenuh. Salah satunya yaitu benzena yang merupakan senyawa
hidrokarbon tak jenuh akan tetapi
benzena tidak mengalami reaksi adisi melainkan reaksi substitusi, yang
berupa substitusi elektrofilik.
SUBSTITUSI
KEDUA
Suatu benzena tersubstitusi dapat mengalami
substitusi kedua. Benzena tersubstitusi bereaksi lebih mudah daripada benzena
itu sendiri. Inti benzena yang mengikat gugus pengaktif akan bereaksi lebih
cepat dalam subtitusi elektrofilik daripada benzena, sedangkan yang mengikat
gugus pendeaktif akan bereaksi lebih lambat.
Gugus-gugus yang meningkatkan laju
reaksi dinamakan gugus pengaktif sedangkan gugus yang memperlambat laju
reaksi disebut gugus pendeaktif. Gugus-gugus yang termasuk kelompok
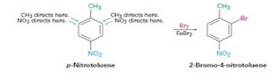
pengarah orto-para sebagian bersifat pengaktif dan sebagian lainnya bersifat pendeaktif,
sedangkan gugus-gugus pengarah meta semuanya termasuk dalam kelompok
pendeaktif. Jika suatu gugus dikatakan sebagai pengaruh orto-para tidak mutlak
diartikan bahwa gugus yang baru seluruhnya diarahkan keposisi orto dan para.
Halogen termasuk kelompok gugus
pengarah orto-para, tetapi gugus ini mendeaktifkan inti. Kekhususan pada
halogen ini dapat dijelaskan dengan asumsi bahwa efek induksinya mempengaruhi
kereaktifan dan efek resonansinya menentukan orientasi. Pada senyawa
klorobenzena, karena atom klor sangat elektronegatif maka diperkirakan terjadi
penarikan elektron pada inti benzena dan karena itu mendeaktifkan inti benzena
dalam reaksi subtitusi elektrofilik.
Ada 3 buah posisi pada benzene :
Serangan orto dan para membentuk ion
bromonium dan struktur resonansi lainnya.
tidak terjadi ion bromonium pada serangan
posisi meta.
Tabel. Efek substituen pada substitusi
elektrofilik senyawa aromatik
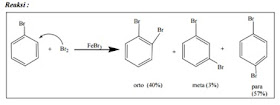
Contoh substitusi ke 2 pada bromobenzene :
Mekanisme reaksi :
1. Pembentukan elektrofil
2. Penyerangan elektrofil pada orto
3. Penyerangan pada meta.E
4. Penyerangan pada para.
SUBSTITUSI KETIGA
Terdapat
beberapa aturan umum dalam
substitusi ketiga :
1.
Jika dua substituen itu
mengarahkan suatu gugus masuk ke satu posisi, maka posisi ini akan merupakan
posisi utama dari substitusi ketiga
2.
Jika dua gugus
bertentangan dalam efek – efek pengarahan mereka, maka aktivator yang lebih
kuat akan diturut pengarahannya
3.
Jika
dua gugus dekativasi berada pada cincin, terlepas dari mana posisi mereka,dapat
menyukarkan substitusi ketiga.
4. Jika
dua gugus pada cincin berposisi-meta satu sama lain, baisanya cincin itu tidak
menjalani substitusi pada posisi yang mereka apit, meskipun mungkin cincin itu
teraktifkan (pada posisi itu). Tidak reaktifnya posisi ini agaknya disebabkan
oleh rintangan sterik.
KAITAN
DENGAN PERSAMAAN HAMMET
Pada persamaan
ini menjelaskan tentang pengaruh senyawa aromatik pada posisi meta dan para. Akan
tetapi tidak berlaku pada posisi orto, hal ini dikarenakan oleh efek sterik
yang besar sehingga dapat menghalangi posisi orto tersebut dan juga laju
reaksinya sangat cepat. Pengarah meta (gugus deaktivator) meruah yang menyebabkan
elektrofil pada posisi orto tidak dapat masuk, sehingga elektrofil masuk pada
posisi setelahnya, yaitu meta. Begitu pula dengan para dengan posisi terjauh
dari substituen pertama sehingga laju reaksi dari posisi para dan meta dapat
dihitung dengan persamaan Hammett.
PERTANYAAN
1. Apa yang dimaksud dengan gugus aktivator dan pendeaktivator?
2. Apa faktor yang menyebabkan penarikan dan pendonoran elektron oleh gugus substituen dan jelaskan?
DAFTAR PUSTAKA
Allinger, Norman L. et.al. 1976. Organic Chemistry Second edition. New
York:Worth Publishers Inc.
Fessenden, Fessenden. 1992. Kimia Organik Edisi Ketiga. Jakarta:
Erlangga.








Komentar ini telah dihapus oleh pengarang.
BalasHapusTerimakasih atas penjelasannya alissyia, sangat bermanfaat
BalasHapusSaya akan mencoba menjawab pertnyaannya
2.Selain mempengaruhi tempat untuk substitusi kedua, substituen pertama juga mempengaruhi kecepatan reaksi substitusi kedua. Semua pengarah orto, para kecuali halogen akan mempercepat substitusi elektrofil dibandingkan kecepatan reaksi benzena sendiri. Meningkatnya kecepatan reaksi menyebabkan reaksi dapat berjalan dalam keadaan lebih dingin dan tanpa katalisator.
Terimakasih :)
Terimakasih allisyia, menurut saya untuk jawaban nomor 1,yaitu Gugus aktivasi adalah suatu gugus pendorong elektron. gugus ini dapat meningkatkan keaktifan suatu cincin benzena. Sehingga ketika benzena berikatan dengan gugus ini, maka dapat melakukan reaksi lebih lanjut. Gugus aktivasi akan mengakibatkan energi aktivasi menjadi lebih rendah sehingga laju reaksi lebih tinggi. Benzena tersubstitusi dengan gugus aktivasi merupakan pengarah orto dan para.
BalasHapusGugus deaktivasi adalah suatu gugus penarik elektron. gugus ini sangat lambat bereaksi dengan benzena. karena gugus ini dapat menurunkan energi aktivasi. Benzena tersubstitusi dengan gugus deaktivasi merupakan pengarah meta.
terimakasih atas materinya disini Gugus aktivasi akan mengakibatkan energi aktivasi menjadi lebih rendah sehingga laju reaksi lebih tinggi. Benzena tersubstitusi dengan gugus aktivasi merupakan pengarah orto dan para.
BalasHapusGugus deaktivasi adalah suatu gugus penarik elektron. gugus ini sangat lambat bereaksi dengan benzena. karena gugus ini dapat menurunkan energi aktivasi. Benzena tersubstitusi dengan gugus deaktivasi merupakan pengarah meta.
Menurut saya, gugus aktivasi ialah suatu gugus pendorong elektron yang mana dapat meningkatkan keaktifan suatu cincin benzena. Dimana ketika benzena berikatan dengan gugus ini, maka dapat melakukan reaksi lebih lanjut yang akan mengakibatkan energi aktivasi menjadi lebih rendah dan laju reaksi lebih tinggi. Benzena tersubstitusi dengan gugus aktivasi teraebut merupakan pengarah orto dan para. Sedangkan gugus deaktivasi ialah suatu gugus penarik elektron yang mana sangat lambat bereaksi dengan benzena, hal ini dikarenakan gugus ini dapat menurunkan energi aktivasi. Benzena tersubstitusi dengan gugus deaktivasi merupakan pengarah meta.
BalasHapusSelanjutnya faktor yang menyebabkan penarikan dan pendonoran elektron oleh gugus substituen ialah efek induksi (efek yang diakibatkan oleh perbedaan keelektronegatifan resonansi) dan efek resonansi (suatu gugus melalui ikatan phi).
Terimakasih allisyia
BalasHapusUntuk pertanyaannya
2. Apa faktor yang menyebabkan penarikan dan pendonoran elektron oleh gugus substituen? Yaitu faktor induksi dan resonansi yanh dipengaruhi oleh PEB
Adanya PEB mampu mrndorong elektron sehingga bersifat aktivasi
Pengecualian pada halogen dimana walaupun ada PEB namun cenderung menarik elektron
Begitupun sebaliknya dimana gugus tanpa PEB akan menarik elektron
Sekian :)
Komentar ini telah dihapus oleh pengarang.
BalasHapusKomentar ini telah dihapus oleh pengarang.
BalasHapusKomentar ini telah dihapus oleh pengarang.
BalasHapusMenurut saya:
BalasHapus1. Gugus aktivasi adalah suatu gugus pendorong elektron. gugus ini dapat meningkatkan keaktifan suatu cincin benzena. Sehingga ketika benzena berikatan dengan gugus ini, maka dapat melakukan reaksi lebih lanjut. Gugus aktivasi akan mengakibatkan energi aktivasi menjadi lebih rendah sehingga laju reaksi lebih tinggi. Benzena tersubstitusi dengan gugus aktivasi merupakan pengarah orto dan para.
Gugus deaktivasi adalah suatu gugus penarik elektron. gugus ini sangat lambat bereaksi dengan benzena. karena gugus ini dapat menurunkan energi aktivasi. Benzena tersubstitusi dengan gugus deaktivasi merupakan pengarah meta.
2. Faktor yang menyebabkan penarikan dan pendonoran elektron oleh gugus substituen ialah efek induksi dan resonansi. Efek induksi adalah efek yang diakibatkan oleh perbedaan keelektronegatifan antara dua atom atau gugus. Sedangkan efek resonansi yaitu efek menarik atau mendorong elektron dari suatu gugus melalui ikatan pi.
Terimakasih atas materinya..
BalasHapussaya akan menjawab pertanyaan pertama anda..
menurut saya Gugus aktivasi merupakan suatu gugus pendorong elektron. gugus ini dapat meningkatkan keaktifan suatu cincin benzena. Gugus aktivasi akan mengakibatkan energi aktivasi menjadi lebih rendah sehingga laju reaksi lebih tinggi. Benzena tersubstitusi dengan gugus aktivasi merupakan pengarah orto dan para.
Gugus deaktivasi adalah suatu gugus penarik elektron. gugus ini sangat lambat bereaksi dengan benzena. karena gugus ini dapat menurunkan energi aktivasi. Benzena tersubstitusi dengan gugus deaktivasi merupakan pengarah meta
Terima kasih atas materinya
BalasHapusMenurut saya hugus aktivasi akan memperkaya elektron sebagai pengarah orto-para dan gugus deaktivasi mngurangi elektron sebagai pengarah meta
Hai Allisyia , menurut saya gugus-gugus yang meningkatkan laju reaksi dinamakan gugus pengaktif(aktivator), gugus aktivator memiliki PEB sehingga mampu mendonorkan elektronnya ke cincin aromatis, sedangkan gugus yang memperlambat laju reaksi disebut gugus pendeaktif (deaktivator), gugus ini yang tdk memiliki PEB sehingga mampu menarik elektron dari cincin aromatis, hal ini lah yang membawa pada penyebabkan penarikan dan pendonoran elektron oleh gugus substituen yaitu oleh efek induksi dan efek resonansi
BalasHapusterimakasih
Saya akan menjawab soal no 1 menurut saya Gugus aktivasi adalah suatu gugus pendorong elektron. gugus ini dapat meningkatkan keaktifan suatu cincin benzena. Sehingga ketika benzena berikatan dengan gugus ini, maka dapat melakukan reaksi lebih lanjut. Gugus aktivasi akan mengakibatkan energi aktivasi menjadi lebih rendah sehingga laju reaksi lebih tinggi. Benzena tersubstitusi dengan gugus aktivasi merupakan pengarah orto dan para.
BalasHapusGugus deaktivasi adalah suatu gugus penarik elektron. gugus ini sangat lambat bereaksi dengan benzena. karena gugus ini dapat menurunkan energi aktivasi. Benzena tersubstitusi dengan gugus deaktivasi merupakan pengarah meta.
Terimakasih untuk materinya allis. saya akan menjawab pertanyaan pertama dimana :
BalasHapusGugus aktivasi adalah suatu gugus pendorong elektron. gugus ini dapat meningkatkan keaktifan suatu cincin benzena. Sehingga ketika benzena berikatan dengan gugus ini, maka dapat melakukan reaksi lebih lanjut. Gugus aktivasi akan mengakibatkan energi aktivasi menjadi lebih rendah sehingga laju reaksi lebih tinggi. Benzena tersubstitusi dengan gugus aktivasi merupakan pengarah orto dan para.
Gugus deaktivasi adalah suatu gugus penarik elektron. gugus ini sangat lambat bereaksi dengan benzena. karena gugus ini dapat menurunkan energi aktivasi. Benzena tersubstitusi dengan gugus deaktivasi merupakan pengarah meta.