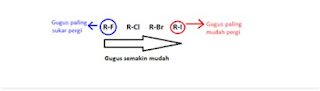
Atom karbon sebagai basis
senyawa organik, adalah atom yang memiliki enam elektron dengan konfigurasi 1s2
2s2 2p2 . Atom karbon mempunyai empat elektron valensi.
Dengan empat elektron valensi tersebut, atom karbon dalam membentuk ikatan
dengan atom lainnya tidak mempunyai kecenderungan melepaskan keempat
elektronnya untuk memenuhi aturan oktet, sehingga dapat membentuk ion positif C4+,
atau menerima empat elektron sehingga menjadi ion negatif C4- .
Sebaliknya, empat elektron pada kulit terluar dapat membentuk empat ikatan
kovalen baik dengan atom karbon maupun dengan atom lain, melalui pemakaian
bersama pasangan elektron.
Sifat khas atom karbon, suatu
sifat yang memungkinkan keberadaan jutaan senyawa organik, adalah kemampuannya
untuk membentuk ikatan tidak saja dengan unsur berbeda, tetapi juga dengan atom
karbon lain. Kemampuan atom-atom karbon untuk membentuk ikatan kovalen
memungkinkan terbentuknya rantai karbon yang beragam. Hal ini merupakan salah
satu penyebab begitu banyak senyawa karbon yang dapat terbentuk. Rantai karbon
dapat merupakan rantai lurus, bercabang, maupun siklis.
Empat ikatan kovalen yang dapat
terbentuk antar atom C dapat berupa ikatan tunggal atau ikatan rangkap,
tergantung dari orbital yang digunakan masing-masing atom karbon tersebut.
PEMBENTUKAN IKATAN
C-C
Ikatan
karbon-karbon adalah ikatan kovalen antara dua atom karbon. Bentuk yang paling
umum adalah ikatan tunggal: ikatan yang tersusun atas dua elektron, satu dari
masing-masing dua atom. Ikatan tunggal karbon-karbon adalah ikatan sigma dan
dikatakan terbentuk dari satu orbital hibrid dari masing-masing atom karbon.
Dalam etana, orbital sp3 adalah orbital hibrid, tetapi ikatan
tunggal terbentuk antara atom karbon dengan hibridisasi lain memang terjadi
(misalnya sp2 ke sp2). Bahkan, atom karbon dalam
ikatan tunggal tidak perlu dari hibridisasi yang sama.
Reaksi ikatan pembentukan karbon-karbon
adalah reaksi organik di mana ikatan karbon-karbon baru terbentuk. Mereka
penting dalam produksi bahan kimia buatan manusia seperti obat-obatan dan
plastik.
1. Melalui reaksi radikal bebas
Tidak
terkendali, dapat melakukan reaksi berantai (tidak digunakan dalam sintesis).
2. Melalui reaksi antara C+ dengan
C-
Lebih terkendali (digunakan dalam sintesis).
Contoh lain reaksi yang membentuk
ikatan karbon-karbon adalah reaksi Aldol, reaksi Diels-Alder, penambahan reagen
Grignard ke grup karbonil, reaksi Heck, reaksi Michael dan reaksi Wittig.
a. Hibridisasi
sp3
Atom
larbon memiliki dua orbital (2s dan 2p) untuk membentuk ikatan, artinya jika
bereaksi dengan hidrogen maka akan terbentuk dua ikatan C-H. Faktanya, atom
karbon membentuk empat ikatan C-H dan menghasilkan molekul metana dengan bentuk
bangun ruang tetrahedron. Linus Pauling (1931) menjelaskan secara matematis
bagaimana orbital s dan tiga orbital p berkombinasi atau terhibridisasi membentuk
empat orbital atom yang ekuivalen dengan bentuk tetrahedral. Orbital yang
berbentuk tetrahedral disebut dengan hibridisasi sp3. Angka tiga menyatakan
berapa banyak tipe orbital atom yang berkombinasi, bukan menyatakan jumlah
elektron yang mengisi orbital.
Atom
karbon memiliki konfigurasi ground-state 1s2 2s2 2px1
2py1. pada kulit terluar terdapat dua elektron dalam orbital 2s, dan
dua elektron tak perpasangan dalam orbital 2p:
Dari konfigurasi di atas, maka
atom karbon hanya dapat membentuk dua ikatan, contohnya CH2. Pada
kenyataannya, molekul CH2 sangat jarang ditemukan dan lebih banyak
terbentuk molekul CH4. Dari hasil eksperimen, diperoleh data bahwa
kekuatan ikatan CH sebesar 100 kkal/mol. Dengan demikian, energi untuk
membentuk ikatan C-H dalam CH2 sebesar 200 kkal/mol.
Pada posisi tereksitasi, karbon
memiliki empat elektron tak berpasangan dan dapat membentuk empat ikatan dengan
hidrogen. Meskipun membutuhkan energi sebesar 96 kkal/mol untuk mengeksitasi
satu elektronnya terlebih dahulu, ikatan yang terbentuk dengan H (pada CH4)
jauh lebih stabil dibandingkan ikatan C-H pada molekul CH2.
b. Hibridisasi
sp2
Ketika
kita membentuk orbital hibridisasi sp3 untuk menjelaskan ikatan dalam metana,
pertama kali yang dilakukan adalah mempromosikan satu elektron dari orbital 2s
ke excited state menghasilkan empat elektron tak berpasangan. Hibridisasi sp2
terjadi jika satu elektron tereksitasi ke orbital p. Akibatnya, atom karbon
yang terhibridisasi sp2 hanya dapat membentuk tiga ikatan sigma dan satu ikatan
pi. Ikatan pi terjadi sebagai akibat dari tumpang tindih elektron pada orbital
2p-2p.
Dua atom karbon sp2 dapat saling membentuk ikatan
yang kuat, mereka membentuk ikatan sigma melalui overlap orbital sp2-sp2.
Kombinasi ikatan sigma sp2-sp2 dan ikatan pi 2p-2p menghasilkan bentuk ikatan rangkap karbon-karbon. Bentuk bangun ruang dari
ikatan atom karbon yang terhibridisasi sp2 adalah trigonal planar.
Etena, H2C=CH2,
adalah salah satu senyawa hidrokarbon yang mengandung ikatan rangkap
karbon-karbon. Pada faktanya, keenam atom pada etena seluruhnya terletak pada
satu bidang datar yang sama. Setiap ikatan dengan karbon berada pada posisi
mengarah pada sudut-sudut sebuah segitiga, dan sudutsudut ikatannya mendekati
120°.
Fakta tersebut menunjukkan atom
karbon pada etena tidak menggunakan orbital s atau orbital p untuk berikatan,
tetapi menggunakan orbital baru yang mempunyai tingkat energi setara dan
bergeometri segitiga planar, yaitu orbital hibrid sp2 . Pada orbital
hibrid sp2 , orbital 2s bergabung atau berhibridisasi dengan dua
orbital 2p, menghasilkan orbital 3 orbital hibrid sp2 . Hibridisasi
ini dapat berlangsung setelah terjadi promosi elektron dari orbital 2s ke
orbital bertingkat energi lebih tinggi, yaitu orbital 2p. Orbital sp2 mempunyai
penataan geometris segitiga datar, sehingga terletak pada satu bidang datar
dengan sudut 120°. Satu orbital p yang tersisa terletak tegak lurus pada bidang
orbital sp2 .

Dua orbital sp2 dari
kedua atom karbon, yang masing-masing berisi satu elektron, overlap ujung ke
ujung sehingga terbentuk ikatan σ C-C. Dua orbital p yang masing-masing juga
berisi satu elektron, overlap sisi ke sisi sehingga membentuk ikatan π antara
atom C dan C. Jadi antara C dan C terbentuk dua ikatan (ikatan rangkap), satu
berupa ikatan σ dan satu lagi berupa ikatan π. Sementara itu, empat orbital 1s
dari H, masing-masing membentuk ikatan σ dengan 4 orbital sp2 karbon.
c. Hibridisasi
sp
Atom
karbon memiliki kemampuan membentuk tiga macam ikatan, yaitu ikatan tunggal,
rangkap dua dan rangkap tiga. Etuna atau HC≡CH
adalah salah satu senyawa hidrokarbon yang
mengandung ikatan rangkap tiga karbon-karbon. Bagaimanakah pembentukan ikatan
rangkap tiga karbon-karbon? Fakta menunjukkan bahwa keempat atom pada etuna
terletak pada satu garis (linier) dengan sudut ikatan 1800 . Hal tersebut
menunjukkan atom karbon dalam etuna menggunakan orbital hibrid sp untuk
berikatan dengan atom-atom lain. Orbital hibrid sp pada karbon terbentuk sebagai
hasil hibridisasi satu orbital 2s dan satu orbital 2p. Dua orbital 2p yang lain
tidak berubah. Penataan geometri orbital sp adalah linier, bersudut 1800 . Dua
orbital p terletak tegak lurus pada orbital sp.

Dua orbital hibrid sp dari dua
atom C membentuk satu ikatan σ C-C, sedangkan orbital-orbital pz dari setiap
karbon membentuk ikatan π pz-pz melalui overlap sisi ke sisi, begitu pula
dengan orbital-orbital py dari setiap karbon yang membentuk ikatan overlap π
py-py melalui overlap sisi ke sisi. Dengan demikian, terbentuk tiga ikatan
(atau ikatan rangkap tiga) antara C dan C, yaitu satu ikatan σ sp2-sp2, dan dua
ikatan π p-p.
1) Reaksi
substitusi nukleofilik
Pada reaksi substitusi nukleofilik atom/ gugus
yang diganti mempunyai elektronegativitas lebih besar dari atom C, dan
atom/gugus pengganti adalah suatu nukleofil, baik nukleofil netral atau
nukleofil yang bermuatan negatif.
Reaktivitas
relatif dalam reaksi substitusi nukleofilik dipengaruhi oleh reaktivitas
nukleofil, struktur alkilhalida dan sifat dari gugus terlepas. Reaktivitas
nukleofil dipengaruhi oleh basisitas, kemampuan mengalami polarisasi, dan
solvasi.
Pada
dasarnya terdapat dua mekanisme reaksi substitusi nukleofilik. Mereka
dilambangkan dengan SN2 adan SN1. Bagian SN menunjukkan substitusi nukleofilik,
sedangkan arti 1 dan 2 akan dijelaskan kemudian.
v
Reaksi SN2
Mekanisme
SN2 adalah proses satu tahap yang dapat digambarkan sebagai berikut:
Nukleofil menyerang dari belakang ikatan C-X. Pada keadaan
transisi, nukleofil dan gugus pergi berasosiasi dengan karbon di mana
substitusi akan terjadi. Pada saat gugus pergi terlepas dengan membawa pasangan
elektron, nukleofil memberikan pasangan elektronnya untuk dijadikan pasangan
elektron dengan karbon. Notasi 2 menyatakan bahwa reaksi adalah bimolekuler,
yaitu nukleofil dan substrat terlibat dalam langkah penentu kecepatan reaksi
dalam mekanisme reaksi. Adapun ciri
reaksi SN2 adalah:
1. Karena
nukleofil dan substrat terlibat dalam langkah penentu kecepatan reaksi, maka
kecepatan reaksi tergantung pada konsentrasi kedua spesies tersebut.
2. Reaksi
terjadi dengan pembalikan (inversi) konfigurasi. Misalnya jika kita mereaksikan
(R)-2-bromobutana dengan natrium hidroksida, akan diperoleh (S)-2-butanol.Ion
hidroksida menyerang dari belakang ikatan C-Br. Pada saat substitusi terjadi,
ketiga gugus yang terikat pada karbon sp3 kiral itu seolah-olah terdorong oleh
suatu bidang datar sehingga membalik. Karena dalam molekul ini OH mempunyai
perioritas yang sama dengan Br, tentu hasilnya adalah (S)-2-butanol. Jadi
reaksi SN2 memberikan hasil inversi.
3. Jika
substrat R-L bereaksi melalui mekanisme SN2, reaksi terjadi lebih cepat apabila
R merupakan gugus metil atau primer, dan lambat jika R adalah gugus tersier. Gugus
R sekunder mempunyai kecepatan pertengahan. Alasan untuk urutan ini adalah
adanya efek rintangan sterik. Rintangan sterik gugus R meningkat dari metil
< primer < sekunder < tersier. Jadi kecenderungan reaksi SN2 terjadi
pada alkil halida adalah: metil > primer > sekunder >> tersier.
v
Reaksi SN1
Mekanisme SN1 dalah proses dua tahap. Pada tahap pertama,
ikatan antarakarbon dengan gugus pergi putus.
Gugus pergi terlepas dengan membawa pasangan
elektron, dan terbentuklah ion karbonium. Pada tahap kedua (tahap cepat), ion
karbonium bergabung dengan nukleofil membentuk produk
Pada
mekanisme SN1, substitusi terjadi dalam dua tahap. Notasi 1 digunakan sebab
pada tahap lambat hanya satu dari dua pereaksi yang terlibat, yaitu substrat.
Tahap ini sama sekali tidak melibatkan nukleofil.
Berikut ini adalah ciri-ciri
suatu reaksi yang berjalan melalui mekanisme SN1:
a)
Kecapatan
reaksinya tidak tergantung pada konsentrasi nukleofil. Tahap penentu kecepatan
reaksi adalah tahap pertama di mana nukleofil tidak terlibat.
b)
Jika
karbon pembawa gugus pergi adalah bersifat kiral, reaksi menyebabkan hilangnya
aktivitas optik karena terjadi rasemik. Pada ion karbonium, hanya ada a gugus
yang terikat pada karbon positif. Karena itu, karbon positif mempunyai
hibridisasi sp2 dan berbentuk planar. Jadi nukleofil mempunyai dua arah
penyerangan, yaitu dari depan dan dari belakang. Dan kesempatan ini
masing-masing mempunyai peluang 50 %. Jadi hasilnya adalah rasemit. Misalnya,
reaksi (S)-3-bromo-3-metilheksana dengan air menghasilkan alkohol rasemik.
Spesies antaranya (intermediate species) adalah ion
karbonium dengan geometrik planar sehingga air mempunyai peluang menyerang dari
dua sisi (depan dan belakang) dengan peluang yang sama menghasilkan X yang
melalui mekanisme SN1-adalah campuran rasemik Reaksi substrat R akan
berlangsung cepat jika R merupakan struktur tersier, dan lambat jika R adalah
struktur primer. Hal ini sesuai dengan urutan kestabilan ion karbonium, 3°
> 2° >> 1°.
v
Perbandingan Mekanisme SN1 dan
SN2
Pada tahap pertama dalam mekanisme SN1 adalah tahap
pembentukan ion, sehingga mekanisme ini dapat berlangsung lebih baik dalam
pelarut polar. Jadi halida sekunder yang dapat bereaksi melalui kedua mekanisme
tersebut, kita dapat mengubah mekanismenya dengan menyesuaikan kepolaran
pelarutnya. Misalnya, mekanisme reaksi halida sekunder dengan air (membentuk
alkohol) dapat diubah dari SN2 menjadi SN1 dengan mengubah pelarutnya dari 95%
aseton-5% air (relatif tidak-polar) menjadi 50% aseton-50% air (lebih polar,
dan pelarut peng-ion yanglebih baik). Kekuatan nukleofil juga dapat mengubah
mekanisme reaksi yang dilalui oleh reaksi oleh reaksi SN. Jika nukleofilnya
kuat maka mekanisme SN2 yang terjadi.
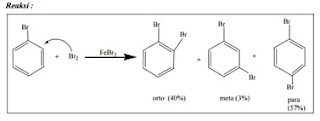
2) Reaksi
Substitusi Elektrofilik
Ada
4 macam reaksi substitusi elektrofilik terhadap senyawa aromatik, yaitu:
v Reaksi
eliminasi
Yaitu pelepasan atom atau gugus atom. Merupakan
reaksi samping pada reaksi substitusi, dikenal dengan eliminsi E1 dan E2.
a.
Mekanisme
reaksi E1
Mekanisme
reaksi E1 merupakan alternatif dari mekanisme reaksi SN1. Karbokation dapat
memberikan sebuah proton kepada suatu basa dalam reaksi eliminasi. Mekanisme
reaksi E1 terdiri dari dua tahap. Perhatikan contoh berikut :
Tahap 1.
Tahap 1
reaksi E1 berjalan lambat.
Tahap 2.
Tahap 2
reaksi E1 berjalan cepat.
Mekanisme reaksi E2
Reaksi E2
menggunakan basa kuat seperti OHˉ, ORˉ, dan juga membutuhkan kalor. Dengan
memanaskan alkil halida dalam KOH, CH3CH2ONa.
DAFTAR
PUSTAKA
Allinger,
Norman L. et.al. 1976. Organic Chemistry.
Second edition. New York:Worth Publishers Inc.
Fessenden,
Fessenden. 1992. Kimia Organik Edisi
Ketiga. Jakarta: Erlangga
Hart,
H., Craine, L.E., Hart, D.J. 2003. Kimia
Organik. Jakarta: Erlangga.
McMurry,
J. 2007. Organic Chemistry,7th Edition.
California : Wadsworth Inc.
Morrison,
R.T, Boyd,R.N. 1992. Organic Chemistry,
7th Edition, New Jersey : Prentice Hall Inc.
PERTANYAAN
1. Apa itu ikatan sigma dan ikatan
phi?
2. Sebutkan reaksi yang dapat
memmbentuk ikatan karbon-karbon?
3.
Apa
perbedaan SN1 dan SN2?