STEREOKONTROL DAN PEMBENTUKAN CINCIN
Stereocontrol dalam
pembentukan cincin adalah masalah utama untuk sintesis produk alami siklik.
Selain reaksi Diels-Alder, ada beberapa metode, dengan mana stereoselektivitas
di beberapa pusat asimetris diamankan pada saat bersamaan. Ada
contoh yang menggambarkan kemampuan untuk mempengaruhi dan kadang-kadang
mengontrol selektivitas wajah dari reaksi dalam sistem asiklik dan siklik.
Pembatasan dari bab ini adalah fokus perhatian pada metode untuk mengendalikan
konformasi mempengaruhi dalam molekul, atau mengeksploitasi pengaruh konformasi
yang tidak dapat dipahami untuk mencapai tujuan sintetis tertentu.
1.
Kontrol Stereo pada Sistem Asiklis
Reaksi
pada molekul asiklis dapat menghasilkan diastereomer dan pengertian
“penontrolan stereokimia”, yang biasanya digunakan untuk suatu usaha
menghasilkan satu diastereomer sebagai produk utama dari reaksi. Usaha – usaha
untuk mengontrol stereokimia yang penting meliputi:
a) Selektivitas
Markonikov/ anti markonikov
Jika reaksi menghasilkan karbokation, maka orientasi Markonikov pasti
dihasilkan. Jika diinginkan adisi anti-Markonikov, maka pengubahan pada
mekanisme reaksi harus terjadi.
Reaksi adisi lain yang berlangsung dengan orientasi anti-Markonikov
adalah adisi HBr pada alkena dengan adanya peroksida. Reaksi radikal ini
berlangsung dengan baik hanya untuk adisi HBr dan tidak untuk HCl atau HI.
Reaksi adisi tipe radikal akan berlangsung dengan bentuk anti–Markonikov.
Pada umumnya, reaksi adisi kation dan radikal menghasilkan intermediet
reaktif, dan produk adisi ditentukan oleh stabilisasi relatif dari intermediet.
Pengotrolan adisi Markonikov vs
anti-Markonikov dapat diprediksi dengan pengontrolan jalur mekanistik adisi.
Reaksi HBr dengan 2-metil-2-butena yang
menghasilkan 2-bromo-2-metil-butana.
b) Retensi
vs Inversi Konfigurasi
Contoh sederhana untuk menginversi pusat stereokimia adalah mengkonversi
gugus fungsi menjadi gugus fungsi lainnya. Proses ini biasanya melibatkan
alkohol atau substrat amina. Jika alkohol dikonversi menjadi turunan dengan
ikatan C – O lemah serta adanya kecenderungan yang besar untuk terjadinya
penggantian ,maka tipe SN2 menjadi mungkin dengan inversi pusat
stereogenik tersebut. Contoh sederhana proses ini adalah konversi (S)-2-pentanol menjadi tosilat yang
sesuai, yang dapat diganti dengan nukleofilik seperti azida dan ada hasil,
dengan kontrol sempurna pusat stereogenik. Ini merupakan metode efektif untuk
menginversi pusat stereo dengan pengikatan gugus fungsi yang berbeda.
Metode lain selain reaksi Mitsonobu juga dapat dipeoleh
untuk menghasilkan stereokimia. Gugus amino dapat diubah menjadi gugus fungsi
yang lain. Konversi yang menarik adalah transformasi NH2 →Br, dengan
hasil retensi konfigurasi secara sempurna. Reaksi asam amino dengan Natium
Nitrit (Na2NO2) dan Kalium Bromida (KBr) menghasilkan
asam α-bromo, dengan retensi
konfigurasi secara sempurna.
Contoh pengontrolan konfigurasi pusat khiral
adalah konversi alkohol sekunder khiral menjadi klorida sekunder yang sesuai
dengan tionil klorida.
c) Selektivitas cis-trans
Kontrol pada geometri cis-trans telah ditunjukkan pada reduksi alkuna engan hidrogenasi
katalitik atau dengan logam alkali. Katalis Lindlar memungkinkan terjadinya
reduksi secara selektif terhadap alkuna menjadi cis-alkena. Keadaan yang berlawanan, reaksi alkun dengan logam
alkali akan menghasilkan trans-alkena.
Sekali lagi, pengertian utama terhadap perbedaan dua mekanisme reaksi tersebut
memungkinkan pengontrolan geometri cis-trans
produk akhir.
Katalis Lindlar memungkinkan terjadinya
reduksi secara selektif terhadap alkuna menjadi cis-alkena.
d) Selektivitas syn-anti
Produk-produk akhir dari serangkaian reaksi
ini adalah syn diastereomer dan anti diastereomer. Rekasi lain di mana syn dan anti diastereomer dapat dibentuk, tetapi satu yang perdominan,
yaitu pada contoh konversi alkena menjadi 1,2-diol.
Hasil yang diperoleh adalah syn-diol. Dalam beberapa hal,mungkin
mengontrol pembukaan cincin epoksida,terutama terhadap molekul siklis,seperti
pada reaksi 1-fenilsikloheksena oksida dengan hidroksida.
Metode untuk menghasilkan diol secara
streoselektif dimulai dengan epoksida yang dibentuk dengan mengoksidasi alkena
yang dibuka menjadi diol dengan hidroksida
e) Khelasi
Heteroatom
Keadaan ini dapat ditunjukkan pada reaksi alkohol alilik khiral dengan
asam peroksi. Koordinasi dengan oksigen dan pelepasa oksigen elektrofilik dari
sisi tersebut menghasilkan alkohol epoksi.
Kecenderungan terjadinya khelat heteroatom tegantug pada pereaksi yang
digunakan. Zink borohidrida mengadakan koordinasi yang sangat kuat dengan
heteroatom, tetapi litium aluminium hidrida menunjukan selektivitas yang
kurang.hal ini disebabkan oleh koordinasi yang lemah dengan heteroatom.
2.
Kontrol Stereo pada Sistem Siklis
Pada dasarnya sama seperti pada sistem asiklis. Sukar untuk memisahkan
pengaruh regiokimia (cara adisi) dan pengaruh retensi dibandingkan inversi dan isomerisasi
cis-trans pada molekul-molekul
siklis. Adisi pada ikatan π tersubtitusi menghasilkan isomer-isomer geometri, dan pada sebagian
besar sistem siklis akan mengontrol konfigurasi absolut pusat khiral yang
dikaitkan dengan isomer-isomer cis-trans dan/atau
dengan pembentukan diastereomer. Pengertian syn
dan anti tidak mempunyai arti
pada sistem siklis.
a) Selektivitas
Markonikov / anti-Markonikov
Masalah-masalah yang berkaitan dengan adisi secara regioselektif pada
molekul-molekul siklis pada dasarnya sama seperti pada molekul-molekul asiklis.
Sebagai contoh, reaksi HBr dengan metilsiklopentena merupakan regioselektivitas
yang tinggi untuk produk Markonikov yang menghasilkan tersierbromida,
1-bromo-1-metilsiklopentana.
Reaksi Hbr dengan
metilsiklopentena merupakan regioselektivitas yang tinggi untuk produk
Markovnikov yang menghasilkan tersier bromida, 1-bromo-1-metilsiklopentena.
b) Aturan
Bredt
Reaksi lain di mana
regioselektivitas bersifat penting adalah pembentukan ikatan rangkap pada
reaksi eliminasi. Regiokontrol pada eliminasi diperoleh dengan pengikatan basa
pada molekul (basa internal untuk eliminasi syn)
atau dengan pengikatan basa pada molekul seperti pada reaksi biomolekul (basa
eksernal untuk eliminasi anti).
Penambahan pada halida dengan kalium-t-butoksida
dalam t-butanol menghasilkan
antieliminasi, dan membentuk alkena yang lebih banyak tersubtitusi. Hal ini
disebabkan sifat termodinamika reaksi dan persyaratan elektronik bahwa kedudukan
gugus pergi anti terhadap hidrogen
yang dilepaskan. Efek yang sama terjadi pada halida siklis seperti cis-2-1- metilsiklopentana, yang bila
direaksikan dengan basa menghasilkan metilsiklopentana.

Perbedaan utama di sini adalah ketidakmampuan
cincin berotasi di sekitar ikatan karbon-karbon, tetapi produk yang dihasilkan
adalah alkena yang lebih banyak tersubtitusi. Untuk syn dan anti eliminasi
keduanya, hidrogen-β dan gugus pergi adalah sudah ditentukan oleh regiokimia
halida.
Reaksi molekuler siklis yang melibatkan pembentukan pusat-pusat khiral
mirip seperti yang terjadi pada system asiklik. Reaksi asida (NaN3) dengan cis - 4
–t-butil-1-bromo-sikloheksana. Menghasilkan azida,dengan inversi konvigurasi
penuh Melalui jalur reaksi SN2.contoh:
Perbedaan utama antara system siklis dan
system ansiklis adalah ketidakmampuan sistem siklis mengalami rotasi disekitar
ikatan karbon-karbon yang menghasilkan perbedaan konfigurasi.
c) Isomer-isomer
cis-trans (diastereoselektivitas)
Pada system siklis, pengontrolan geometric cis-trans merupakan persoalan
diastereoseletivitas. Konformasi cicin, kemampuan kekonformasian pada keadaan
transisi,dan stabilitas produk akhir,merupakan hal yang penting untuk
mengkontrol dan memprediksi
stereokimia.Contoh : Reduksi 4-t-butilsilkoheksanon menunjukan
kemantapan yang ditandai pelapisa hibrida melalui jalur a (perbandingan a : b = 91 :
9),selama reaksi dengan LiAlH4 yang menghasilkan trans-alkohol)
:
3.
Pengaruh Khelasi dan Gugus Tetangga
Pengaruh
gugus sederhana yang di pengaruhi pelepasan
“oksigen” ke ikatan rangkap dua
alcohol telah dikemikakan oleh Henberst dan Sharless. Ini merupakan pengaruh
untuk reaksi asiklis.Epoksidasi senyawa 6.100 berlangsung melalui koordinasi
asam peroksi dengan alcohol.pelepasan berbedah dengan epoksidasi alitik asetat
yang terutma menghasilkan pelepasan oksigen elektofilik dari muka yang kurang
berpenghalang.
Pengaruh gugus seperti ini disebabkan oleh
pengaruh khelasi subtituen heteroatom dengan pereakai.
4.
Stereo Kontrol Asiklis
melalui precursor siklis
Sistem siklis dapat digunakan
untuk memprediksikan gugus fungsi,sering dengan control regiokimia dan
steriokimia.Cincin kemudian dibuka untuk memperperoleh system asiklis ,dan regioimia dan strereokimia
subtituen telah ditetapkan (ditemukan).
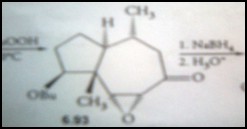
Contoh penerapan masalah dilakukan dengan cara disintesis senyawa
organic secara efektif.
REAKSI PEMBENTUKAN
CICIN
Pengenalan dari aturan
Baldwin untuk penutpan cicin. mempelajari nukleofil,homolitik,dan proses
penutupan cicin kationik,dan mendapatkan pola reaktifitas yang dapat relativ
diprediksi. Pendekatan ini didasarkan pada persyaratan-persyaratan steriokimia
dan sudut pendekatan yang memungkinkan untuk membawa ersama-sama dua pusat reaktif bila dihubungkan dengan atom-atom
(tether).Baldwin mengklasifikasikan penutupan cicin menjadi dua kategori : EXO (aliran electron dari reaksi adalah
eksternal terhadap cicin yang akan dibentuk) dan ENDO (aliran elektro didalam
cicin yang akan dibntuk)..Peningkatan atom pada sp2 disebut
TRIG (membentuk cicin) dan peningkatan hibridisasi pada atom sp disebut DIG(
pembentukan cicin).
Sudut ikat pada ikatan
rangkap tiga adalah 180°,karena molekul adalah linear.Dalam hal in konversi
atop sp menjadi atom sp2 menghasilkan sudut ikat 120° yang merupakan karekteristik
alkena.Menggunakan analog yang sama seprti pada koversi sp2 -sp3
atom harus mendekati ikatan rangkap tiga pada sudut sekitar 120°.
Contoh siklis endo,konversi sitronelal oleh pengaruh katalisator asam H+ menjadi isopulegol
Enolat pada umumnya mengalami reaksi
5-endo-tring pada oksigen sedangkan reaksi 6-endo-tring disukai pada
karbon.untuk membentuk cicin lingkar dari lima dari pasangan electron bebas
oksigen harus pada kedudukan yang tepat
untuk menggantikan kedudukan brom pada 6.136( produk adalah tetrahidrofuran).
DAFTAR PUSTAKA
Sastrohamidjojo,
Hardjono Dkk .2009. Sintesis Senyawa
Organic.Jakarta : Erlangga.
Takashi Tokoroyama, Masamitsu Tsukamoto,
And Hideo Iio. 1984. “Remarkable Stereocontrol Observed In The Ring Formation By Intramolecular
Hosomi-Sakurai Reactionl”. J. Tetrahedron
Letters. Vol. 25(44).
PERTANYAAN
1. Pada faktor yang mempengaruhi distereoselektivitas pada asiklik ialah Selektivitas
syn-anti, dicontohkan bahwa konversi
alkena menjadi 1,2-diol menghasilkan syn-diol.
Bagaimana syn-diol didapatkan?
2. Apa yang membedakan sistem siklis dan antisiklis?
3. Pada sistem asiklis reaksi anti-Markonikov adalah adisi HBr pada
alkena dengan adanya peroksida. Reaksi ini menghasilkan radikal karbon. Bagaimana
radikal dapat terbentuk?